Medikuntzako oheei ohe medikoak, ohe medikoak, erizaintzako oheak... ere deitu daitezke. Ospitaleratuta daudenean gaixoek erabiltzen dituzten oheak dira. Batez ere ospitale nagusietan, udalerriko osasun zentroetan, komunitateko osasun zerbitzuen zentroetan eta abarretan erabiltzen dira.
AEBetako FDAk eskatzen du elikagaiak eta produktu medikoak AEBetako merkatuan sartzen direnean, AEBetako FDAren webgune ofizialean erregistratu behar direla AEBetako merkatuan sartu aurretik.
Ospitaleko oheak I Klaseko gailu mediko gisa sailkatzen dira FDAn. AEBetako Elikagaien eta Drogen Administrazioak honela definitzen ditu I. Klaseko gailuak: "ez dira bizitzari eusteko edo bizitzari eusteko erabiltzeko, edo gizakien osasunari kalteak ekiditeko garrantzitsuak izan daitezen, eta baliteke "gaixotasun edo arrazoizko arriskurik ez duten gailuak ez izatea". lesioa». Gailu hauek FDAk araututako gailuen kategoria ohikoena dira, merkatuan onartutako gailuen % 47 hartzen baitute. I. klaseko gailuek pazientearen kontaktu minimoa dute eta eragin txikia dute pazientearen osasun orokorrean. Normalean, I. klaseko gailuak ez dira gaixoaren barne-organoekin, nerbio-sistema zentralarekin edo sistema kardiobaskularrekin harremanetan jartzen. Gailu hauek gutxieneko arauzko eskakizunen mende daude.
Gailu medikoen FDAren ziurtagiriak honako hauek dira: fabrikatzailearen erregistroa FDAn, produktuaren FDA erregistroa, produktuen zerrendaren erregistroa (510 inprimakiaren erregistroa), produktuen zerrenda (PMA berrikuspena), etiketatzea eta eraldaketa teknikoa, aduana-garbiketa, erregistroa eta merkaturatu aurreko txostenak osasun-laguntzarako gailuak, Material hauek aurkeztu behar dira:
(1) Guztiz ontziratutako produktu amaituen bost kopia
(2) Gailuaren egituraren diagrama eta testuaren deskribapena
(3) Gailuaren errendimendua eta funtzionamendu-printzipioa
(4) Gailuaren segurtasun erakustaldia edo probako materialak
(5) Fabrikazio-prozesuaren hastapenak
(6) Entsegu klinikoen laburpena
(7) Produktuaren argibideak. Gailuak propietate erradioaktiboak baditu edo material erradioaktiboak askatzen baditu, zehatz-mehatz deskribatu behar da.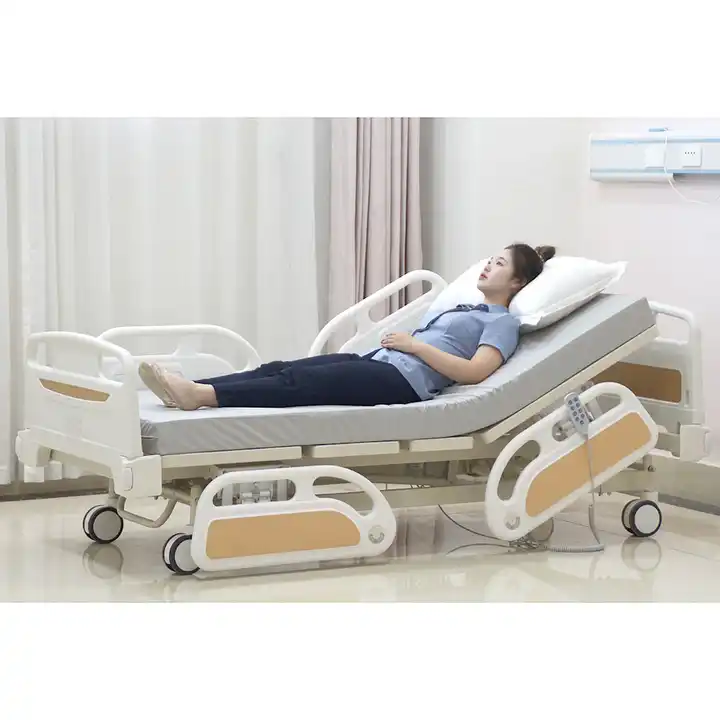
Proiektuaren Zikloa
FDAren ebaluaziotik azken onespenera arteko denbora, oro har, luzeagoa da eta FDAk kontrolatzen du; normalean prozesu normalaren ziklo osoa 12 hilabete ingurukoa da
Ospitaleko oheetarako 510K eskaera prozesua honako hau da:
1. FDA 510(K) dokumentu teknikoak betetzeko baldintzak
2. AEBetako FDA 510k erregistroari aplikatzen zaion analisi estandarra
3. Dauden dokumentuen erabilgarritasuna egiaztatzea
4. Merkatuan erregistratutako produktuak biltzea eta alderatzea
5. Prestatu produktuaren informazioa AEBetako FDA 510k eskakizunen arabera
6. Prestatu 510k erregistro-dokumentuak estandarren arabera
7. Erregistro-agirien berrikuspen-emaitzetan oinarritutako berrikuspenak egitea
8. Enpresaren erregistroa eta produktuen zerrendaren erregistroa osatu
taishaninc-ek esportazio-ziurtagiri globala du
Osoko jabetzako 5 filial ditu
Eraikuntzako materialen, produktu kimikoen eta gailu medikoen industriak estaltzen ditu
Esportazio globalaren ziurtagiria duen fabrika bat gara, urteko 5.000.000 $-ko balioarekin eta mundu osoko 160 herrialde baino gehiagotara esportatzen ditugu. Inguruko industria-parke integratuko fabrikarik handiena gara. Beharrezkoa izanez gero, jarri gurekin harremanetan garaiz eta bidali produktuaren informazio zehatza.
Argitalpenaren ordua: 2023-11-21




